|
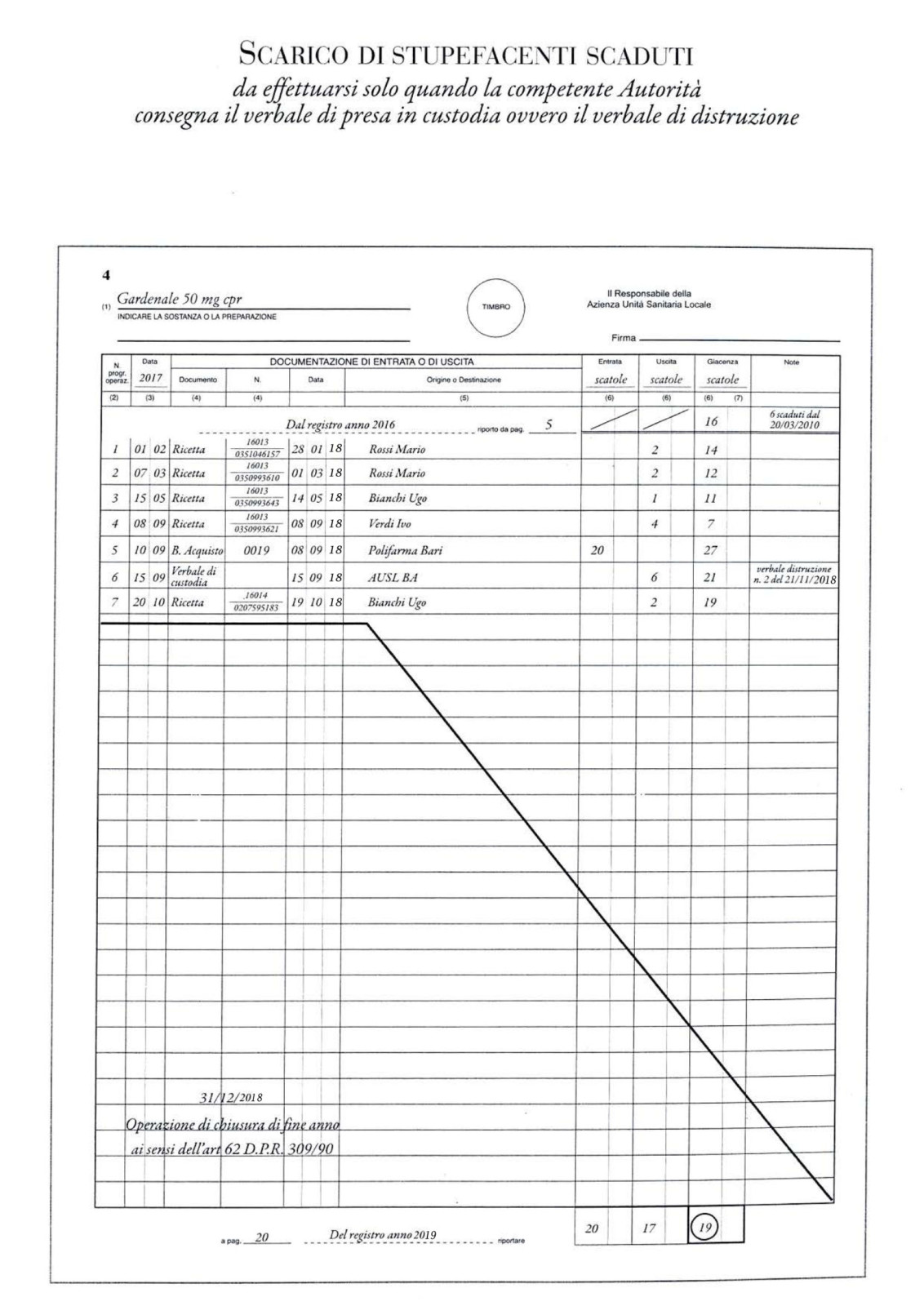
Al fine di favorire il rispetto delle specifiche norme di settore, si ritiene utile fornire un breve riepilogo degli adempimenti professionali e delle scadenze di fine anno: REGISTRO DI ENTRATA ED USCITA E DISTRUZIONE STUPEFACENTI (artt. 60, 62 e 68 D.P.R. n. 309/1990) Il registro di entrata ed uscita stupefacenti deve essere chiuso il 31 dicembre di ogni anno. La chiusura si compie mediante scritturazione riassuntiva di tutti i dati comprovanti i totali delle qualità e quantità dei prodotti avuti in carico e delle quantità e qualità dei prodotti impiegati o commercializzati durante l’anno, con l’indicazione di ogni eventuale differenza o residuo.
Come si ricorderà, con la modifica introdotta dalla L. 38/2010, qualora le irregolarità riscontrate siano relative a violazioni della normativa regolamentare sulla tenuta dei registri di cui al comma 1, si applica la sanzione amministrativa del pagamento di una somma da euro 500 a euro 1.500. Pertanto, nel caso in cui si verifichino incongruenze tra le movimentazioni inserite nel registro e le giacenze di magazzino, sarà necessario denunciare tempestivamente alle competenti autorità di polizia il furto o lo smarrimento dei medicinali, in modo da poter regolarizzare la situazione, annotando sul registro la denuncia. Da un punto di vista operativo, si consiglia di sostituire annualmente il registro dopo la chiusura e, a tal proposito, si rammenta che la L. 38/2010 ha modificato l’art. 60 del D.P.R. 309/1990, introducendo la durata di due anni per l’obbligo di conservazione del registro. In proposito, si evidenzia che, a seguito dell’entrata in vigore del decreto del Ministero della Salute 9 novembre 2015, in materia di produzione nazionale di sostanze e preparazioni di origine vegetale a base di cannabis, sul registro di entrata e uscita deve ora essere registrata anche la movimentazione relativa alle sostanze attive di origine vegetale a base di cannabis. Con riguardo alla distruzione di medicinali stupefacenti, si ritiene opportuno specificare quanto segue. Con nota del 24.5.2011 il Ministero della Salute ha fornito alcuni chiarimenti sulla distruzione delle sostanze e composizioni medicinali stupefacenti scadute o deteriorate non utilizzabili farmacologicamente. In particolare, il Ministero, nel riepilogare la procedura prevista per le farmacie, ha precisato quanto segue. I medicinali stupefacenti scaduti o deteriorati non utilizzabili farmacologicamente, soggetti ad obbligo di registrazione (Tabella dei medicinali, sezioni A, B e C), devono essere oggetto di una constatazione da parte della ASL con redazione del relativo verbale. I prodotti da distruggere, sigillati in un contenitore con contrassegni d’ufficio, sono affidati al farmacista, su indicazione del quale viene concordato se incaricare della termodistruzione la ASL o un’azienda autorizzata allo smaltimento: Termodistruzione effettuata dalla ASL La ASL concorda la data della distruzione con le Forze di Polizia ed eventualmente con l’azienda autorizzata allo smaltimento. Al ritiro dei medicinali, il farmacista può scaricare i medicinali dal registro. Delle operazioni di distruzione le Forze di Polizia redigono apposito verbale. Termodistruzione effettuata da una azienda autorizzata allo smaltimento L’azienda autorizzata allo smaltimento concorda con le Forze di polizia la data della distruzione. All’atto del ritiro dei medicinali, l’azienda autorizzata allo smaltimento dei rifiuti consegna al farmacista il relativo documento di presa in carico, con cui il farmacista scarica il registro. Delle operazioni di distruzione le Forze di Polizia redigono apposito verbale i cui estremi sono annotati dal farmacista quale giustificativo finale dell’uscita delle composizioni medicinali dal registro degli stupefacenti; una copia del verbale viene inviata dalla farmacia alla ASL. I medicinali stupefacenti scaduti o deteriorati, non utilizzabili farmacologicamente, non soggetti ad obbligo di registrazione (tabella dei medicinali, sezioni D ed E), possono essere avviati dal farmacista a termodistruzione e trattati come gli altri rifiuti sanitari. TRASMISSIONE ALL’AIFA DEI DATI RELATIVI AI PRINCIPI ATTIVI VIETATI PER DOPING Come è noto, con DM 24.10.2006, successivamente modificato dal DM 18.11.2010, il Ministero della Salute ha previsto le modalità di trasmissione, da parte dei farmacisti, dei dati relativi ai principi attivi vietati per doping. I farmacisti sono tenuti a trasmettere, esclusivamente in modalità elettronica, entro il 31 gennaio 2019, al Ministero della Salute, i dati riferiti all’anno 2018 relativi alle quantità utilizzate e vendute di ogni singolo principio attivo vietato per doping, secondo le modalità indicate sul sito internet del Ministero della Salute all’indirizzo www.salute.gov.it, nella sezione “Antidoping” (ove è possibile scaricare il modulo per la trasmissione dei dati e le relative istruzioni per la compilazione e l’invio). Non sono soggetti a trasmissione i dati relativi alle quantità di:
Il farmacista è tenuto a conservare, le ricette originale se RNR e in copia se RR o i fogli di lavorazione che giustificano l’allestimento di tutti i preparati contenenti sostanze vietate per doping soggetti a trasmissione dei dati, per sei mesi a decorrere dal 31 gennaio dell’anno in cui viene effettuata la trasmissione. SANZIONI PER VIOLAZIONI DEGLI OBBLIGHI DI COMUNICAZIONE AL SISTEMA TESSERA SANITARIA Com’è noto, in base a quanto stabilito dal DLgs 175/2014, ai fini dell’elaborazione da parte dell’Agenzia delle entrate della dichiarazione dei redditi precompilata, le farmacie hanno l’obbligo di inviare al Sistema tessera sanitaria i dati relativi alle prestazioni erogate. Le modalità di trasmissione telematica delle spese sanitarie al Sistema Tessera Sanitaria, sono state individuate con DM 31 luglio 2015. Con due distinti decreti, DM 2 agosto 2016 e DM 1 settembre 2016, l’obbligo in questione è stato esteso rispettivamente ad ulteriori strutture, tra cui quelle riferite alla vendita al dettaglio dei medicinali veterinari (grossisti autorizzati alla vendita diretta ed alle parafarmacie). In particolare, si evidenzia che la trasmissione dei dati deve essere effettuata entro il 31 gennaio dell’anno successivo (ad es. per le spese sanitarie sostenute nell’anno 2018, la trasmissione telematica dei relativi dati deve essere effettuata entro il 31/1/2019), come indicato dal DM 31/7/2015. Si rammenta inoltre che, dal 1° gennaio 2016, in caso di omessa, tardiva o errata trasmissione dei dati in questione si applica la sanzione di euro 100 per ogni comunicazione, con un massimo di euro 50.000. Nei casi di errata comunicazione dei dati la sanzione non si applica se la trasmissione dei dati corretti è effettuata entro i cinque giorni successivi alla scadenza, ovvero, in caso di segnalazione da parte dell’Agenzia delle Entrate, entro i cinque successivi alla segnalazione stessa. Se la comunicazione è correttamente trasmessa entro sessanta giorni dalla scadenza prevista, la sanzione è ridotta a un terzo con un massimo di euro 20.000 Si fa inoltre presente che, in base a quanto previsto dall’art. 10 bis del DL 119/2018, recante disposizioni urgenti in materia fiscale e finanziaria, convertito nella Legge 136/2018, pubblicata nella Gazzetta Ufficiale n. 293 del 18.12.2018, i soggetti, tra cui i farmacisti, tenuti all’invio dei dati al Sistema tessera sanitaria sono esonerati, per il periodo d’imposta 2019, dall’obbligo di fatturazione elettronica tra privati inizialmente introdotto, con decorrenza dal 1° gennaio 2019, dalla L. 205/2017, (art. 1, comma 909 e ss. A tal proposito va peraltro precisato che l’esonero non riguarda in ogni caso la parte “passiva”, ovvero la ricezione dei documenti di fatturazione in formato elettronico da parte dei fornitori. Resta quindi la necessità per le farmacie di dover adeguare la propria infrastruttura tecnologica ed organizzativa per poter gestire correttamente i flussi di fatturazione provenienti dai fornitori. Resta inoltre confermato, come già previsto dal decreto fiscale che le farmacie e le parafarmacie possono adempiere all’obbligo di memorizzazione e trasmissione telematica dei corrispettivi mediante la memorizzazione elettronica e la trasmissione telematica dei dati relativi ai corrispettivi giornalieri al Sistema tessera sanitaria. Ai sensi dell’art. 15 del DL 119/2018 sopra citato, a partire dalle operazioni IVA relative all’anno 2020, l’Agenzia delle Entrate metterà a disposizione di tutti i soggetti passivi dell’IVA, residenti e stabiliti in Italia, in apposita area riservata del sito internet dell’Agenzia stessa, le bozze dei seguenti documenti:
Per i soggetti passivi IVA che convalidano nel caso in cui le informazioni proposte dall’Agenzia delle entrate siano complete ovvero integrano nel dettaglio i dati proposti nelle bozze dei suddetti documenti, viene meno l’obbligo di tenuta dei registri delle fatture emesse e degli acquisti. * * * Bastoncini per le orecchie in materiale biodegradabile e compostabile dal 2019 e di prodotti cosmetici da risciacquo che non contengono microplastiche Come previsto dalla legge n. 205/2017 (art. 1, commi da 545-548, a decorrere dal 1° gennaio 2019 non è più consentito produrre e commercializzare sul territorio nazionale bastoncini per la pulizia delle orecchie che abbiano il supporto in plastica o comunque in materiale non biodegradabile e compostabile ai sensi della norma UNI EN 13432. E’ altresì obbligatorio indicare, sulle confezioni dei bastoncini, informazioni chiare sul corretto smaltimento dei bastoncini stessi, citando in maniera esplicita il divieto di gettarli nei servizi igienici e negli scarichi. Inoltre, a decorrere dal 1° gennaio 2020, viene introdotto il divieto di commercializzazione di prodotti cosmetici da risciacquo ad azione esfoliante o detergente contenenti microplastiche. E’ previsto che il trasgressore del divieto commercializzazione di prodotti cosmetici da risciacquo ad azione esfoliante o detergente contenenti microplastiche (introdotto dal comma 318-quinquies) sarà punito con la sanzione amministrativa pecuniaria da 2.500 a 25.000 euro, aumentata fino al quadruplo del massimo se la violazione del divieto riguarda quantità ingenti di prodotti cosmetici oppure un valore della merce superiore al 20% del fatturato del trasgressore. Distinti saluti. IL PRESIDENTE Sen. Dott. Luigi D’Ambrosio Lettieri |